
HPB: Terapia Combinada de início precoce
A hiperplasia prostática benigna (HPB), também conhecida como aumento prostático (AP), é a quarta condição patológica mais comum no homem adulto, atrás de hipertensão arterial sistêmica (HAS), diabetes melito (DM) e depressão1.
Estima-se que mais de 50% dos homens com 50 anos de idade e quase 90% dos homens com 2 80 anos apre-sentem algum grau de alteração histológica desta condição . Estima-se, ainda, que um em cada quatro homens busque atendimento médico para a HPB aos 80 anos 3.
Como a incidência da doença aumenta com o avanço da idade, espera-se que a população em risco aumente com o envelhecimento populacional geral. De fato, o Departamento de Censo dos EUA projeta que a população de homens de 45 anos crescerá 45%, para 64,7 milhões neste ano de 2020 4.
Existem quatro opções principais para o tratamento da HPB: espera vigilante, terapia farmacológica, procedi- mentos minimamente invasivos e cirurgia . A espera vigilante geralmente é escolhida por pacientes com sinto-mas não incômodos e/ou desejo de evitar complicações, efeitos colaterais e custos de outras intervenções mé-dicas. Para pacientes sintomáticos, a terapia farmacológica com um bloqueador alfa-adrenérgico e/ou um inibi-dor da alfa-redutase (5ARI) é frequentemente o tratamento inicial de escolha 5. Os procedimentos cirúrgicos minimamente invasivos (MISTs) incluem várias abordagens como, por exemplo, expansores uretrais, vaporiza- ção por vapor de água, ablação por jato de água e embolização prostática, entre outros, enquanto as terapias cirúrgicas incluem procedimentos como ressecção ou incisão transuretral da próstata, vaporização e enuclea-ção transuretral a laser e prostatectomia simples aberta, videolaparoscópica ou robô-assistida 6,7.
O objetivo principal atual do tratamento para sintomas do trato urinário inferior associados à hiperplasia prostá-tica benigna (LUTS/HPB) é tanto reduzir os sintomas incômodos, quanto o gerenciamento clínico, agora focado em alterar a progressão da doença e prevenir complicações a longo prazo, como cirurgia ou retenção urinária aguda (RUA) 8,9.
Em relação à terapia farmacológica, os alfabloqueadores agem diminuindo o tônus muscular liso na próstata, uretra e bexiga (colo vesical), proporcionando alívio sintomático rápido 10. Atualmente, os alfabloqueadores indicados para prática clínica são reconhecidos como igualmente eficazes no tratamento dos sintomas da HPB pelas sociedades urológicas nacional e internacionais 5,10. Os alfabloqueadores não têm efeito no volume da próstata e demonstraram ser ineficazes na redução de complicações relacionadas à progressão da HPB, como RUA e necessidade de cirurgia da próstata 2,10,11. Por outro lado, os 5ARIs reduzem o tamanho da próstata e melhoram os sintomas urinários após 3 a 6 meses de terapia em homens com HPB e também reduzem o risco de progressão para RUA e necessidade de cirurgia 10-14.
Nos quase 30 anos de história de ambas as classes, os alfabloqueadores têm dominado a preferência prescri-tiva entre os médicos, justamente pelo seu início de ação mais imediato, proporcionando alívio mais precoce e melhora da percepção do paciente sobre sua condição. Entretanto, devido à subutilização dos 5ARIs em detri-mento dessas medicações, há um número expressivo de pacientes que evoluíram para quadros de RUA ou necessidade de intervenção cirúrgica 2.
Há uma tendência para o uso de terapia combinada com um alfabloqueador e um 5ARI, ou usando tratamento sequencial com um alfabloqueador inicial para controle rápido dos sintomas, seguido por um 5ARI para modificação da doença 10,11. O atraso no início de um 5ARI, como no tratamento sequencial com 5ARI, pode reduzir os benefícios a longo prazo e estar associado à maior probabilidade de RUA e cirurgia. Sendo assim, alguns estudos objetivaram avaliar diferenças nos desfechos dos pacientes em relação ao momento da adição da terapia com 5ARI à terapia inicial com alfabloqueadores nos pacientes tratados para a HPB.
Grandes estudos clínicos indicam redução significativa no risco de cirurgia relacionada à RUA e à HPB em paci-entes tratados com terapia combinada 11,15. Além disso, o estudo de combinação de dutasterida e tansulosina (CombAT), com duração de quatro anos, mostrou que a combinação de dutasterida e tansulosina foi mais eficaz que a monoterapia com tansulosina na redução do risco relativo de RUA, cirurgia relacionada à HPB e progres-são clínica da HPB em homens com sintomas do trato urinário inferior (STUI) moderados ou graves sob risco aumentado de progressão da doença 16.
Não é possível prever quais pacientes apresentarão resposta sustentada ao longo do tempo, mesmo que os sin- tomas iniciais mais graves e/ou próstatas maiores sejam prognósticos para deterioração dos sintomas 17,18. Faltam biomarcadores suficientemente sensíveis e específicos para discriminar o risco de progressão da res-posta ao tratamento a longo prazo em pacientes individuais, considerando a fisiopatogenética da HPB, que ainda se encontra em fase de exploração do conhecimento 19,20.
Atualmente, a resposta ao tratamento é avaliada, tanto em ensaios clínicos, quanto na prática clínica, por parâ- metros clínicos como o International Prostate Symptom Score (IPSS), o fluxo máximo na urofluxometria e parâ-metros de imagem, como espessura vesical, volume prostático e resíduo pós-miccional, em comparação ao pla- cebo ou à terapia ativa.
No entanto, isso não fornece informações sobre o efeito do tratamento na taxa de progressão ao longo do tem-po; em vez disso, descreve a magnitude da mudança em um intervalo ou intervalo de tempo predefinido 21,22. Pelo contrário, qualquer tentativa de linearizar ou interpolar as taxas de progressão subjacentes ao longo do tempo, a partir de alterações observadas entre visitas consecutivas, pode levar a estimativas imprecisas da progressão da doença 21.
Um estudo observacional retrospectivo utilizando dados de dois grandes bancos de dados americanos avaliou 2.636 homens acima de 50 anos com diagnóstico de HPB e tratados com terapia combinada de alfabloqueador e 5ARI, com estes sendo introduzidos em até, no máximo, 6 meses após o início do tratamento com alfabloque-ador, subdivididos em grupos a cada 30 dias em que aconteceu essa introdução do 5ARI. O desfecho avaliado foi a progressão clínica da doença a partir de 150 dias do início da terapia combinada. Do montante total, em torno de 60% dos homens iniciaram a terapia combinada no período de 30 dias da introdução inicial do alfablo-queador. Em ambos bancos de dados, os pacientes do grupo mais tardio da introdução do 5ARI (após 6 meses do início do alfabloqueador) apresentaram maior razão de chances (odds ratio– OR) de cursarem com progres-são clínica (OR = 1.857; p <0,0001e OR = 1.435; p < 0,0002), RUA (OR = 1.709; p < 0,0001 e OR =1.472; p < 0,0006) e necessidade de cirurgia (OR = 2.083; p <0,0001 e OR = 1.282; p = 0,0699). Foi concluído que cada 30 dias de atraso na introdução do 5ARI resultou em aumento na chance de ocorrência da progressão clínica de 21% (OR = 1.211), aumento da chance de RUA de 18,6% (OR = 1.186) e aumento da chance de necessidade de cirurgia para HPB de 26,7% (OR = 1.267). Apesar das limitações do estudo (retrospectivo, e os dados analisados nesse estu- do foram obtidos a partir de duas populações de assistência gerenciada comercialmente representativas em âmbito nacional, mas que podem não refletir outros perfis populacionais), foi possível concluir que o início preco ce da terapia combinada, quando houver critérios de indicação, diminui a chance de progressão clínica da HPB, bem como os desfechos de RUA e necessidade de cirurgia 23.
A fim de corroborar de forma mais robusta essa assertiva, foi desenvolvido um modelo longitudinal usando da-dos de ensaios clínicos randomizados e estudos de acompanhamento, incluindo placebo, tansulosina, dutaste-rida e terapia combinada, que permitiram a caracterização de trajetórias ou perfis individuais de IPSS 24,25. Esse modelo propiciou a oportunidade de avaliar o impacto de diferentes intervenções, levando em consideração o papel de outros fatores covariáveis conhecidos por afetar a resposta em pacientes com STUI/HPB moderados ou graves 24,25.
Foram feitas simulações em computador a partir das características basais de pacientes participantes de ensa-ios clínicos anteriores para caracterizar a deterioração dos sintomas associados a taxas variáveis de progressão da doença e avaliar os efeitos a longo prazo de diferentes intervenções com base nas trajetórias individuais do IPSS, com o objetivo de avaliar as implicações do início tardio da terapia combinada em pacientes com sinto-mas moderados e graves. Foram, então, criados sete cenários, desde a introdução imediata da terapia combina-da até a associação do 5ARI após 48 meses, sendo que todos pacientes foram inseridos na associação até 24 meses, incluindo, ao todo, 10.238 pacientes 25.
Esse modelo longitudinal de cenários com base em ensaios clínicos randomizados evita o efeito de fatores de confusão que não podem ser anulados em metanálises, bem como permite a investigação de características do desenho dos estudos que possam modificar os desfechos, sem restrições práticas ou que constituam fator de
confusão antes de submeter os pacientes a uma intervenção experimental. Ele pode ser utilizado em cenários hipotéticos, especialmente em situações em que um estudo prospectivo e controlado pode esbarrar em aspec-tos éticos, inclusive, como neste caso, em pacientes que apresentem potencial risco para progressão da HPB. No caso deste estudo, foi possível avaliar o atraso do início do tratamento proposto até 24 meses, separando de outros fatores e interações, proporcionando a oportunidade para avaliar o efeito da progressão da doença, as covariantes de linha de base e o tratamento medicamentoso nas trajetórias individuais do IPSS 25. A inexistên-cia de um biomarcador específico confiável para a identificar e predizer um fenótipo específico para progressão da HPB levou à adoção do IPSS como parâmetro a ser utilizado para tal fim, sem a atenção necessária às outras variáveis e comorbidades com impacto na progressão da doença, mas que pode ser contornado com a carac- terização adicional das trajetórias individuais do IPSS. Entretanto, deve-se considerar que as diferenças fenotípicas podem ser responsáveis pelas diferentes respostas aos 5ARIs e alfabloqueadores 20.
Os cenários de simulação dos ensaios clínicos confirmaram o impacto antecipado do atraso na terapia combi-nada, com as diferenças observadas no IPSS no 48º mês tendo sido determinadas por esse atraso. A partir dos 6 meses, uma proporção significativamente menor de respondedores foi observada em cada braço virtual de tratamento em relação ao braço de terapia combinada (Tabela 1). Nenhum outro fator, além da persistência dos
sintomas, pareceu prever a falta de resposta ou explicar quais pacientes mudariam da monoterapia com tansulosina após 6, 12 ou 24 meses 25.
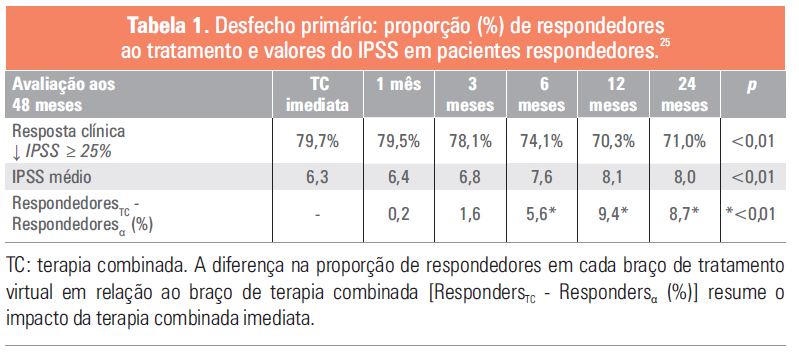
O impacto do início tardio do tratamento combinado também se refletiu no número total de pacientes que fize-ram a transição das categorias de IPSS graves ou moderadas para leves durante o período de 48 meses, avalia-do pela porcentagem de respondedores por braço de tratamento com diminuição no IPSS ≥ 25%, ≥ 35%, ≥ 50% ou ≥ 75% em relação à linha de base (Tabelas 2 e 3) 25.
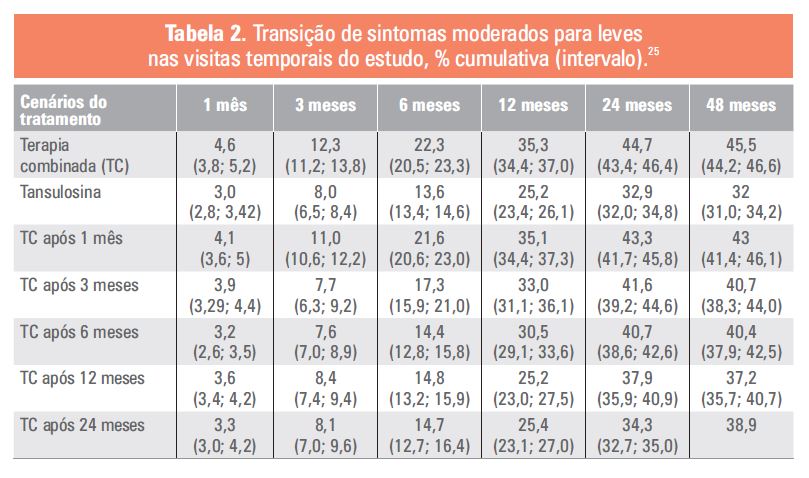
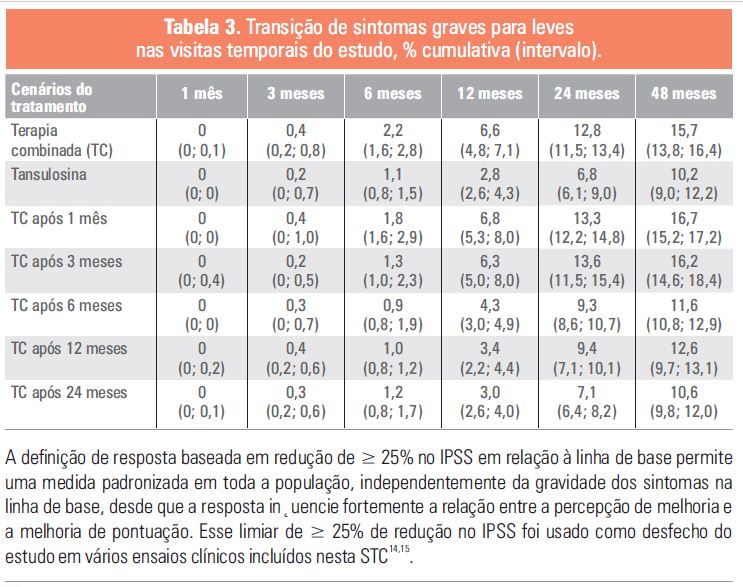
Esses resultados indicam, então, que uma proporção significativa dos pacientes apresenta maior melhora nos sintomas quando a terapia combinada é iniciada imediatamente ou até, no máximo, 6 meses após a introdução do alfabloqueador, com maior fração de pacientes em transição para níveis mais baixos de gravidade do IPSS. O início precoce do tratamento combinado permite que cerca de mais de 10% dos pacientes se beneficiem da melhora sintomática. Além disso, foi possível inferir que o tratamento puramente sintomático com alfabloque-ador não interrompe a progressão da doença e reduz potencialmente os benefícios associados às proprieda-des modificadoras da doença 5-ARI, se o atraso do tratamento for superior a 6 meses 25. Isso pode ser um grande diferencial, especialmente na fração de pacientes com taxa de progressão mais rápida da doença e que
possam ter impacto positivo mais duradouro com a terapia combinada. Portanto, considerando a natureza crô-nica da doença, o efeito das propriedades modificadoras da doença não pode ser compensado por intervenções
sintomáticas a longo prazo. Entretanto, são necessários estudos de longo prazo após 48 meses para verificar se os efeitos benéficos da terapia combinada são ainda duradouros, assim como seu perfil de segurança preservado 25.
Acesse o caso clínico da Urologia.
Bibliografia
1. Issa MM, Fenter TC, Black L, et al. An assessment of the diagnosed prevalence of diseases in men 50 years of age or older. Am J Manag Care. 2006;12(4 Suppl):S83-9.
2. Naslund MJ, Issa MM, Grogg AL, et al. Clinical and economic outcomes in patients treated for enlarged pros-tate. Am J Manag Care. 2006;12 (4 Suppl):S111-6.
3. McConnell JD, Bruskewitz R, Walsh P, et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Engl J Med. 1998; 338:557-63.
4. US Census Bureau. US interim projections by age, sex, race, and Hispanic origin.
Disponível em: http://www.census.gov/ipc/www/usinterimproj/. Acessado em 21 de
maio de 2020.
5. McVary KT, Roehrborn CG, Avins AL, et al. Update on AUA guideline on the management
of benign prostatic hyperplasia. J Urol. 2011;185:1793-803.
6. Foster HE, Dahm P, Kohler TS, et al. Surgical Management of Lower Urinary Tract Symptoms Attributed to Benign Prostatic Hyperplasia: AUA Guideline Amendment 2019. J Urol. 2019 Sep;202(3):592-8.
7. Gravas S, Cornu JN, Drake MJ, et al. EAU guidelines on the management of nonneurogenic male lower urinary tract symptoms (LUTS), incl. benign prostatic obstruction (BPO). 2019. Disponível em: http://uroweb.org/guideline/treatment-of-non-neuro gen-icmale-luts/. Acessado em 21 de maio de 2020.
8. Emberton M, Cornel EB, Bassi PF, et al. Benign prostatic hyperplasia as a progressive disease: a guide to the risk factors and options for medical management. Int J Clin Pract. 2008;62:1076-86.
9. O’Leary MP. LUTS, ED, QOL: alphabet soup or real concerns to aging men? Urology. 2000; 56:7-11.
10. Barkin J, Guimaraes M, Jacobi G, et al. Alpha blocker therapy can be withdrawn in the majority of men following initial combination therapy with the dual 5 alpha reductase inhibitor dutasteride. Eur Urol. 2003;44:461-6.
11. McConnell JD, Roehrborn CG, Bautista OM, et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia. N Eng J Med. 2003;349:2387-98.
12. Bruskewitz R, Girman CJ, Fowler J, et al. Effect of finasteride on bother and other healthrelated quality of life aspects associated with benign prostatic hyperplasia. PLESS Study Group. Proscar Long-term Efficacy and Safety Study. Urology. 1999; 54:670-8.
13. Roehrborn CG, Boyle P, Nickel JC, et al. On behalf of the ARIA3001, ARIA3002, and ARIA3003 Study Investigators. Efficacy and safety of a dual inhibitor of 4-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia. Urology. 2002; 60:434-41.
14. Baldwin KC, Ginsberg PC, Roehrborn CG, et al. Discontinuation of alphablockade after initial treatment with finasteride and doxazosin in men with lower urinary tract symp-toms and clinical evidence of benign prostatic hyperplasia. Urology. 2001; 58:203-9.
15. Debruyne F, Barkin J, van Erps P, et al. Efficacy and safety of long-term treatment with the dual 5 alpha reductase inhibitor dutasteride in men with symptomatic benign prostatic hyperplasia. Eur Urol. 2004;46:488-94 (discussion 95).
16. Roehrborn CG, Barkin J, Siami P, et al. Clinical outcomes after combined therapy with dutasteride plus tamsulosin or either monotherapy in men with benign prostatic hyperplasia (BPH) by baseline characteristics: 4-year results from the randomized, doubleblind Combination of Avodart and Tamsulosin (CombAT) trial. BJU Int. 2011;107:946-54.
17. Kozminski MA, Wei JT, Nelson J, Kent DM. Baseline characteristics predict risk of progression and response to combined medical therapy for benign prostatic hyperplasia (BPH). BJU Int. 2015;115:308-16.
18. Pinto F, Racioppi M, Sacco E, et al. Progression, risk factors and subsequent medical management of symptomatic benign prostatic hyperplasia. Arch Ital Urol Androl. 2009; 81:1-8.
19. Fitzpatrick JM. The natural history of benign prostatic hyperplasia. BJU Int. 2006; 97(Suppl 2):3–6 (discussion 21–2).
20. Strand DW, Costa DN, Francis F, et al. Targeting phenotypic heterogeneity in benign prostatic hyperplasia. Differentiation. 2017; 96:49-61.
21. Chan PL, Holford NH. Drug treatment effects on disease progression. Annu Rev Pharmacol Toxicol. 2001;41:625-59.
22. Jonsson F, Marshall S, Krams M, Jonsson EM. A longitudinal model for non-monotonicclinical assessment scale data. J Pharmacokinet Pharmacodyn. 2005;32:795-815.
23. Naslund M, Eaddy MT, Hogue SL, Kruep EJ, Shah MB. Impact of delaying 5-alpha reductase inhibitor therapy in men on alpha-blocker therapy to treat BPH: assessment of acute urinary retention and prostate-related surgery. Curr Med Res Opin. 2009; Nov;25(11):2663-9.
24. D’Agate S, Wilson T, Adalig B, et al. Development of a drug-disease model describing individual IPSS trajectories in BPH patients: implication of disease progression and covariate factors on long term treatment response. In: Annual Meeting of the Population Approach Group in Europe (PAGE). 2018; Montreux, Switzerland. P 27 Abstr 8794.
25. D’Agate S, Wilson T, Adalig B, et al. Impact of disease progression on individual IPSS trajectories and consequences of immediate versus delayed start of treatment in patients with moderate or severe LUTS associated with BPH. World J Urol. 2020; Feb;38(2):463-72.
DR. RICARDO LUÍS VITA NUNES CRM-SP 94.052
Doutor em Urologia pela Facul- dade de Medicina da USP. Chefe da Clínica de Urologia do Hospi-tal Militar de Área de São Paulo do Exército Brasileiro. Diretor do Departamento de Integração As-sociativa da Sociedade Brasilei-ra de Urologia. Coordenador da Área de Hiperplasia Prostática Benigna da Sociedade Brasileira de Urologia. Chefe do Departa-mento de Hiperplasia Prostática Benigna da Sociedade Brasileira de Urologia – Seccional São Paulo.

Sorry, the comment form is closed at this time.