
Caso Clínico – UROLOGIA
Identificação
Paciente JSS de 63 anos de idade, sexo masculino, pardo, casado, 3 filhos e 6 netos, taxista, católico, natural de Pirassununga-SP e procedente de São Paulo-SP.
Queixa
Refere que há aproximadamente 6 meses iniciou quadro de dificuldade para segurar e urinar.
História
Refere que há aproximadamente 6 meses iniciou quadro de jato urinário fraco com alguma hesitação para iniciá-lo, pequena necessidade de esforço auxiliar, gotejamento terminal e, eventualmente, sensação de esvaziamento incompleto. Logo a seguir, observou que começou a ir mais frequente-mente ao banheiro durante o dia e, em algumas oportunidades, com necessidade urgente de chegar ao banheiro, embora nunca tenha perdido urina.
Além disto, mudou o comportamento de seu sono, no qual já estava acostumado a acordar uma vez durante a madrugada, em seu período final, para urinar. Atualmente está acordando entre duas a três vezes para tal, eventualmente com urgência, o que já lhe provocou, inclusive, uma queda por ter escorregado no tapete, sem maiores consequências. Isso tudo está prejudicando seu dia a dia pessoal e, principalmente, profissional, uma vez que algumas vezes precisa parar o carro em estabelecimentos em que haja banheiro disponível durante a corrida com clientes em seu táxi. Relata tam-bém episódios de maior sonolência, assim como comprometimento de seu vigor físico e sexual, embora não relate dificuldade em obter a ereção.
Refere acompanhamento prévio irregular com urologista (a cada 3 anos, em média) e com clínico geral (a cada dois anos, mas este ano já teve uma consulta).
Foi aplicado o questionário de escore de sintomas International Prostate Symptoms Score (IPSS), o qual apresentou resultado de 08/35, com subescore de esvaziamento pontuando 6 e o subescore de armazenamento pontuando 2 (na questão da noctúria). Em relação ao questionamento sobre qualidade de vida, o paciente pontuou 3, ou seja, não está nem satisfeito, nem insatisfeito.
Antecedentes Pessoais e Familiares
Refere tratamento de hipertensão arterial sistêmica com losartana potássica e atenolol, em doses habituais. Nega qualquer outra medicação de uso contínuo. Ex-tabagista, fumou em torno de 1 a 2 maços/dia durante 45 anos e interrompeu há 5 anos. Etilista moderado. Nega drogadição ou alergi-as. Cirurgias prévias para hérnia inguinal esquerda e apendicite na infância/adolescência colecistectomia videolaparoscópica há 3 anos.
Pais falecidos idosos por problemas cardiovasculares. Sem antecedente conhecido de neoplasias malignas na família próxima.
Exame Físico
Paciente em bom estado geral, corado, hidratado, afebril, anictérico e orientado.
• Pressão arterial: 120×70 mmHg; frequência cardíaca: 65 batimentos por minuto; frequência respiratória: 12 incursões por minuto; temperatura: 36,2°C.
• Respiratório: murmúrio vesicular presente em ambos os hemitóraces, sem ruídos adventícios. Cardiovascular: ritmo cardíaco regular em dois tem-pos e sem sopros. Abdominal: abdome plano, depressível, indolor, sem visceromegalias, ruídos hidroaéreos presentes e normoativos. Neurológico: sem alterações significativas.
• Exame digital retal: próstata aumentada em torno de 2x (≈40g), fibroelástica, de limites precisos e definidos e sem nódulos suspeitos.
Conduta Terapêutica e Evolução
A impressão final foi de um paciente adulto maduro, aproximando-se da faixa etária idosa, com quadro de STUI mistos, com predominância do com-ponente de esvaziamento vesical, com algum impacto e prejuízo de sua qualidade de vida, tanto pessoal, quanto profissional.
Diante do quadro e das comorbidades relatadas, foram solicitados exames laboratoriais e imagenológicos complementares, assim como urofluxo-metria livre para analisar o padrão de suas micções.
Retornou apresentando seus exames realizados. Do ponto de vista laboratorial, apresentava:
• Função renal preservada: creatinina de 0,89 e ureia de 43;
• Perfil hormonal limítrofe: testosterona total 334; FSH 3,2; LH 2,8; SHBG 46;
• Vitamina D diminuída: 22,8;
• PSA total 1,8; PSA livre 0,46; rel L/T 25%;
• Urina tipo I: leucócitos 8.000; eritrócitos 4.500; nitrito –;
• Urocultura negativa.
Do ponto de vista imagenológico:
• Ultrassonografia de rins, vias urinárias e próstata: rins de dimensões e topografia normais, sem cálculos ou dilatação das vias excretoras; bexiga com parede lisa normal (3 mm) e volume inicial 340 ml; próstata aumentada 51 cm³, com IPP 0,9 cm e resíduo pós-miccional de 60 ml.
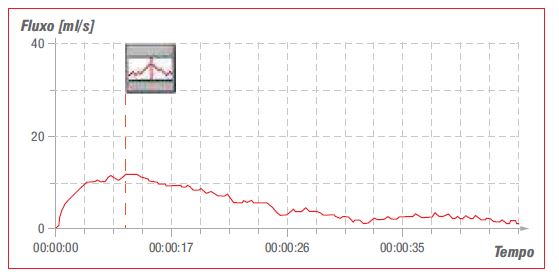
Realizou, também, a urofluxometria livre:
• Volume urinado: 230 ml;
• Qmáx: 12 ml/s;
• Padrão da curva miccional: alongada e achatada.
Perante o quadro apresentado, e após identificados os fatores de risco para progressão da doença, como volume prostático, IPP, PSA e idade, foi proposta terapia combinada inicial com alfabloqueador (tansulosina) e 5ARI (dutasterida). Foi explicado que a introdução precoce da associação pode prevenir desfechos ruins, como RUA e necessidade de cirurgia a longo prazo. Também foram feitas orientações sobre o tempo para se atingir o efeito terapêutico máximo e os possíveis eventos adversos, e a retornar em 6 meses ou a qualquer momento caso houvesse piora clínica ou efeito
indesejável. Foi prescrita também reposição de vitamina D3 (5.000U/dia). O paciente concordou com a proposta terapêutica.
Retornou ao consultório após 6 meses, referindo melhora importante dos sintomas de esvaziamento vesical, com melhora na força do jato, sem gotejamento e sem sensação de esvaziamento incompleto, assim como o retorno ao seu habitual de apenas uma micção durante a madrugada e maior autonomia nos intervalos entre as micções. Sua qualidade de vida pessoal e profissional melhoraram, apesar de alguma queixa do padrão sexual que, apesar de estar mais disposto sexualmente, refere diminuição importante do líquido ejaculado. Indagado se isso poderia configurar um impedimento para a continuidade de seu tratamento, refere estar disposto a se acostumar a essa situação em prol do benefício que obteve em seu
padrão miccional. Foi aplicado o questionário de escore de sintomas (IPSS), com resultado total de 4 (domínio de esvaziamento 3 e domínio de arma-zenamento 1) e qualidade de vida 1.
Trouxe exames de controle:
• Função renal preservada: creatinina de 0,78 e ureia de 41;
• Perfil hormonal melhorado: testosterona total 361; FSH 2,4; LH 2,58; SHBG 41;
• Vitamina D normal: 56,2;
• PSA total 1,5; PSA livre 0,39; rel L/T 26%;
• Urina tipo I: leucócitos 6.000; eritrócitos 4.000; nitrito –;
• Urocultura negativa.
Do ponto de vista imagenológico:
• Ultrassonografia de rins, vias urinárias e próstata: rins de dimensões e topografia normais, sem cálculos ou dilatação das vias excretoras; bexiga com parede lisa normal (3 mm) e com volume inicial de 410 ml; próstata aumentada, 43 cm³, com IPP de 0,8 cm e resíduo pós-miccional de 20 ml.
Realizou também a urofluxometria livre:
• Volume urinado: 280 ml;
• Qmáx: 16 ml/s.
• Padrão da curva miccional: si-nusoidal, com cauda pouco alongada.
Conduta e Desfecho do Caso
Diante da melhora consistente do quadro com a terapia combinada e a compreensão do paciente em relação à diminuição do volume ejaculado como algo manejável e menos importante em comparação ao benefício obtido, ele foi orientado a manter a terapia combinada por mais 6 meses até nova reavaliação e decisão da manutenção do tratamento ou alteração conforme necessidade.
DISCUSSÃO
Os alfabloqueadores agem diminuindo o tônus muscular liso na próstata, uretra e bexiga (colo vesical), proporcionando alívio sintomático rápido 10 . Entretanto, não têm efeito no volume da próstata e demonstraram ser ineficazes na redução de complicações relacionadas à progressão da HPB, como RUA e necessidade de cirurgia da próstata 10,2,11. Por outro lado, os 5ARIs reduzem o tamanho da próstata e melhoram os sintomas urinários após 3 a 6 meses de terapia em homens com HPB e também reduzem o risco de progressão para RUA e necessidade de cirurgia 10,11-14.
Há uma tendência para o uso de terapia combinada com um alfabloqueador e um 5ARI, ou usando tratamento sequencial com um alfabloqueador inicial para controle rápido dos sintomas, seguido por um 5ARI para modificação da doença 10,11 . O estudo CombAT mostrou que a combinação de dutasterida e tansulosina foi mais eficaz que a monoterapia com tansulosina na redução do risco relativo de RUA, cirurgia relacionada à HPB e progressão clínica da HPB em homens com STUI moderados ou graves sob risco aumentado de progressão da doença em quatro anos 16. Na falta de biomarcadores sensíveis e específicos para correlacionar a progressão da HPB para os desfechos negativos, parâmetros clínicos como o IPSS, fluxo máximo na urofluxometria livre e parâmetros de imagem, como espessura vesical, volume prostático e resíduo pós-miccional são atualmente utilizados para avaliar a resposta clínica a tratamentos em ensaios clínicos, bem como na prática clínica, o que, criticamente, pode levar a interpretações imprecisas 19-21.
O atraso no início de um 5ARI, como no tratamento sequencial com 5ARI, pode reduzir os benefícios a longo prazo e estar associado à maior proba-bilidade de RUA e cirurgia. Um estudo observacional retrospectivo em 2.636 homens acima de 50 anos de idade com diagnóstico de HPB tratados com terapia combinada de alfabloqueador e 5ARI observou que, nos pacientes do grupo mais tardio da introdução do 5ARI (após 6 meses do início do alfabloqueador), houve maior razão de chances (odds ratio – OR) destes cursarem com progressão clínica (OR = 1.857; p <0,0001 e OR = 1.435 p < 0,0002), RUA (OR = 1.709; p < 0,0001 e OR = 1.472; p < 0,0006) e necessidade de cirurgia (OR = 2.083; p < 0,0001 e OR = 1.282; p = 0,0699). Foi con-cluído que, a cada 30 dias de atraso na introdução do 5ARI, houve aumento na chance de ocorrência da progressão clínica de 21% (OR = 1.211), au-mento da chance de RUA de 18,6% (OR = 1.186) e aumento da chance de necessidade de cirurgia para HPB de 26,7% (OR = 1.267) 23.
Um outro estudo, de modelo longitudinal usando dados de ensaios clínicos randomizados e estudos de acompanhamento, incluindo placebo, tansu-losina, dutasterida e terapia combinada, caracterizou as trajetórias ou perfis individuais de IPSS e avaliou o impacto de diferentes intervenções, levan- do em consideração o papel de outros fatores covariáveis conhecidos por afetarem a resposta em pacientes com STUI/HPB moderados ou graves, através de sete cenários, desde a introdução imediata da terapia combinada até a associação do 5ARI após 48 meses, sendo que todos pacientes foram inseridos na associação até 24 meses, no total de 10.238 pacientes 24,25. Essa simulação confirmou o impacto antecipado do atraso na tera-pia combinada, sendo que a partir dos 6 meses, uma proporção significativamente menor de respondedores foi observada em cada braço virtual de tratamento em relação ao braço de terapia combinada (p< 0,01). Nenhum outro fator, além da persistência dos sintomas, pareceu prever a falta de resposta ou explicar quais pacientes mudariam da monoterapia com tansulosina após 6, 12 ou 24 meses 24. Esses resultados indicam, então, que uma proporção significativa dos pacientes apresenta maior melhora nos sintomas quando a terapia combinada é iniciada imediatamente ou até, no
máximo, 6 meses após a introdução do alfabloqueador, com maior fração de pacientes em transição para níveis mais baixos de gravidade do IPSS. O início precoce do tratamento combinado permite que cerca de 10% mais pacientes se beneficiem da melhora sintomática, especialmente pacientes com taxa de progressão mais rápida da doença e podem ter impacto positivo mais duradouro com a terapia combinada. Ou seja, o efeito das propri-edades modificadoras da doença não pode ser compensado por intervenções simplesmente sintomáticas a longo prazo 25.
No caso em questão, foi possível verificar que a correta introdução precoce da terapia combinada de alfabloqueador e 5ARI propiciou pronto con-trole sintomático, assim como promoveu controle da progressão da doença, com resultado satisfatório tanto sintomático, quanto de parâmetros
objetivos, indicando sucesso terapêutico.
Acesse o artigo de Terapia Combinada de Início Precoce.
Bibliografia
1. Issa MM, Fenter TC, Black L, et al. An assessment of the diagnosed prevalence of diseases in men 50 years of age or older. Am J Manag Care. 2006;12(4 Suppl):S83-9.
2. Naslund MJ, Issa MM, Grogg AL, et al. Clinical and economic outcomes in patients treated for enlarged prostate. Am J Manag Care. 2006;12 (4 Suppl):S111-6.
3. McConnell JD, Bruskewitz R, Walsh P, et al. The effect of finasteride on the risk of acute urinary retention and the need for surgical treatment among men with benign prostatic hyperplasia. N Engl J Med. 1998; 338:557-63.
4. US Census Bureau. US interim projections by age, sex, race, and Hispanic origin. Disponível em: http://www.census.gov/ipc/www/usinterimproj/. Acessado em 21 de maio de 2020.
5. McVary KT, Roehrborn CG, Avins AL, et al. Update on AUA guideline on the management of benign prostatic hyperplasia. J Urol. 2011;185:1793-803.
6. Foster HE, Dahm P, Kohler TS, et al. Surgical Management of Lower Urinary Tract Symptoms Attributed to Benign Prostatic Hyperplasia: AUA Guideline Amendment 2019. J Urol. 2019 Sep;202(3):592-8.
7. Gravas S, Cornu JN, Drake MJ, et al. EAU guidelines on the management of nonneurogenic male lower urinary tract symptoms (LUTS), incl. benign prostatic obstruction (BPO). 2019. Disponível em: http://urowe b.org/guideline/treatment-of-non-neuro gen-icmale- luts/. Acessado em 21 de maio de 2020.
8. Emberton M, Cornel EB, Bassi PF, et al. Benign prostatic hyperplasia as a progressive disease: a guide to the risk factors and options for medical management. Int J Clin Pract. 2008;62:1076-86.
9. O’Leary MP. LUTS, ED, QOL: alphabet soup or real concerns to aging men? Urology. 2000; 56:7-11.
10. Barkin J, Guimaraes M, Jacobi G, et al. Alpha blocker therapy can be withdrawn in the majority of men following initial combination therapy with the dual 5 alpha reductase inhibitor dutasteride. Eur Urol. 2003;44:461-6.
11. McConnell JD, Roehrborn CG, Bautista OM, et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progressi-on of benign prostatic hyperplasia. N Eng J Med. 2003;349:2387-98.
12. Bruskewitz R, Girman CJ, Fowler J, et al. Effect of finasteride on bother and other healthrelated quality of life aspects associated with benign pros-tatic hyperplasia. PLESS Study Group. Proscar Long-term Efficacy and Safety Study. Urology. 1999; 54:670-8.
13. Roehrborn CG, Boyle P, Nickel JC, et al. On behalf of the ARIA3001, ARIA3002, and ARIA3003 Study Investigators. Efficacy and safety of a dual inhibitor of 4-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia. Urology. 2002; 60:434-41.
14. Baldwin KC, Ginsberg PC, Roehrborn CG, et al. Discontinuation of alphablockade after initial treatment with finasteride and doxazosin in men with lower urinary tract symp-toms and clinical evidence of benign prostatic hyperplasia. Urology. 2001; 58:203-9.
15. Debruyne F, Barkin J, van Erps P, et al. Efficacy and safety of long-term treatment with the dual 5 alpha-reductase inhibitor dutasteride in men with symptomatic benign prostatic hyperplasia. Eur Urol. 2004;46:488-94 (discussion 95). 16. Roehrborn CG, Barkin J, Siami P, et al. Clinical outcomes after combined therapy with dutasteride plus tamsulosin or either monotherapy in men with benign prostatic hyperplasia (BPH) by baseline characteristics: 4-year results from the randomized, doubleblind Combination of Avodart and Tamsulosin (CombAT) trial. BJU Int. 2011;107:946-54.
17. Kozminski MA, Wei JT, Nelson J, Kent DM. Baseline characteristics predict risk of progression and response to combined medical therapy for benign prostatic hyperplasia (BPH). BJU Int. 2015;115:308-16.
18. Pinto F, Racioppi M, Sacco E, et al. Progression, risk factors and subsequent medical management of symptomatic benign prostatic hyperplasia. Arch Ital Urol Androl. 2009; 81:1-8.
19. Fitzpatrick JM. The natural history of benign prostatic hyperplasia. BJU Int. 2006; 97(Suppl 2):3–6 (discussion 21–2).
20. Strand DW, Costa DN, Francis F, et al. Targeting phenotypic heterogeneity in benign prostatic hyperplasia. Differentiation. 2017; 96:49-61.
21. Chan PL, Holford NH. Drug treatment effects on disease progression. Annu Rev Pharmacol Toxicol. 2001;41:625-59.
22. Jonsson F, Marshall S, Krams M, Jonsson EM. A longitudinal model for non-monotonic clinical assessment scale data. J Pharmacokinet Pharma-codyn. 2005;32:795-815.
23. Naslund M, Eaddy MT, Hogue SL, Kruep EJ, Shah MB. Impact of delaying 5-alpha reductase inhibitor therapy in men on alpha-blocker therapy to treat BPH: assessment of acute urinary retention and prostate-related surgery. Curr Med Res Opin. 2009; Nov;25(11):2663-9.
24. D’Agate S, Wilson T, Adalig B, et al. Development of a drug-disease model describing individual IPSS trajectories in BPH patients: implication of disease progression and covariate factors on long term treatment response. In: Annual Meeting of the Population Approach Group in Europe (PAGE). 2018; Montreux, Switzerland. P 27 Abstr 8794.
25. D’Agate S, Wilson T, Adalig B, et al. Impact of disease progression on individual IPSS trajectories and consequences of immediate versus delayed start of treatment in patients with moderate or severe LUTS associated with BPH. World J Urol. 2020; Feb;38(2):463-72.

Sorry, the comment form is closed at this time.