Estudo fase 2/3 da vacina Covid-19 mRNA-1273 para crianças de 6 a 11 anos
ESTUDO CLÍNICO
Creech CB, et al. Estudo fase 2/3 da vacina Covid-19 mRNA-1273 para crianças de 6 a 11 anos. NEJM. 05.11.2022
- Este estudo relata a segurança, a imunogenicidade e a eficácia interina de 2 doses da vacina mRNA-1273 em crianças de 6 a 11 anos como parte do estudo Fase 2/3 KidCOVE
- Parte 1: Seleção de dose de fase aberta (n=751; 380 receberam mRNA-1273 50 μg, 371 receberam mRNA-1273 100 μg)
- Taxas menores de reatogenicidade foram relatadas para a coorte de 50 μg versus 100 μg
- Os títulos médios geométricos (GMT; 1204,6 vs. 1299,9) de anticorpos neutralizantes (nAc) e GMT de anticorpos de ligação (bAc) (333.103 vs. 257.788) foram semelhantes entre as coortes de 50 μg e 100 μg no dia 57
- A dose de 50 μg foi selecionada para a Parte 2 do estudo com base nos resultados de segurança e imunogenicidade.
- Parte 2: Estudo cego para observador, randomizado, controlado por placebo, de expansão para seleção de dose (n=4016; 2998 [99,2%] e 973 [96,9%] receberam 2 injeções de mRNA-1273 50 μg ou placebo, respectivamente)
- As reações adversas locais solicitadas foram relatadas com maior frequência entre os receptores mRNA-1273 do que nos receptores placebo após a dose 1 (94% e 47%) e a dose 2 (95% e 51%).
- As reações adversas locais solicitadas foram semelhantes entre os participantes do KidCOVE de 6 a 11 anos que receberam mRNA-1273 50 μg e jovens adultos participantes do estudo COVE de 18 a 25 anos que receberam mRNA-1273 100 μg
- As reações adversas sistêmicas solicitadas após a dose 1 foram relatadas da mesma forma entre os receptores mRNA-1273 e placebo (58% e 52%); reações adversas sistêmicas solicitadas foram relatadas com mais frequência entre os receptores de mRNA-1273 do que as de placebo após a dose 2 (78% e 50%)
- As reações adversas sistêmicas solicitadas foram menores entre os participantes do KidCOVE do que entre os participantes do COVE com adultos jovens
- Os GMTs de nAb dos participantes do KidCOVE (1610; 95% IC, 1457 a 1780) não foram inferiores aos participantes do COVE com jovens adultos (1300; IC 95%, 1171 a 1443), com uma razão GMT de 1,2 (IC 95%, 1,1 a 1,4); uma diferença de 0,1 pontos percentuais na taxa de resposta sorológica de nAcs foi relatada
- A não inferioridade foi demonstrada quando o limite inferior da IC de 95% para a razão GMT foi ≥0,67 e o limite inferior da IC 95% para a diferença na resposta sorológica foi de ≥-10 pontos percentuais
- Achados semelhantes foram relatados para bAc
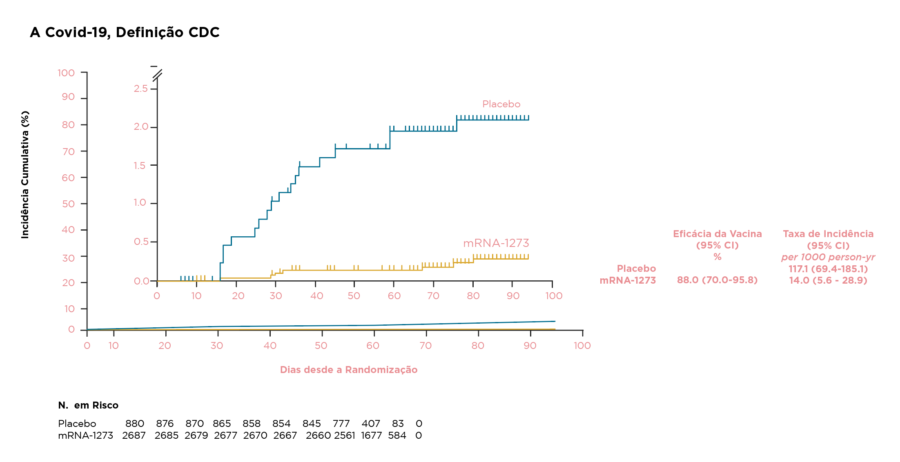
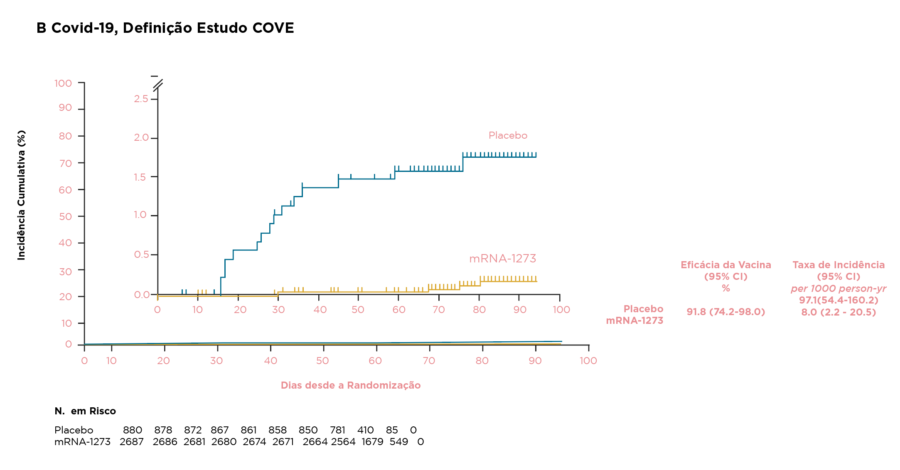
- A eficácia da vacina (VE) contra o COVID-19 sintomática foi de 88,0% (IC95%, 70,0% a 95,8%; conforme definição do CDC) e 91,8% (IC95%, 74,2% e 98,0%; conforme definição do estudo COVE) ≥14 dias após a dose 1; As estimativas de VE foram de 74,0% (IC95%), 57,9% a 84,1%) contra a infecção pelo SARS-CoV-2, independentemente dos sintomas ≥14 dias após a dose 1 e 62,5% (IC 95%, 30,9% a 79,4%) contra infecção por SARS-CoV-2 ≥14 dias após a dose 1
- Não foi possível determinar a VE após a segunda dose da vacina devido ao pequeno número de casos de COVID-19
- As reações adversas locais solicitadas foram relatadas com maior frequência entre os receptores mRNA-1273 do que nos receptores placebo após a dose 1 (94% e 47%) e a dose 2 (95% e 51%).
Figura. Eficácia da vacina após a dose 1
Conclusão: Os achados deste estudo apoiam a administração de duas doses de 50 μg de mRNA-1273 em crianças de 6 a 11 anos
ESTUDO CLÍNICO
Munro APS, et al. Segurança, imunogenicidade e reatogenicidade das vacinas BNT162b2 e mRNA-1273 COVID-19 administradas como reforços de quarta dose após duas doses de ChAdOx1 nCoV-19 ou BNT162b2 e uma terceira dose de BNT162b2 (VOC-BOOST): um estudo fase 2 multicêntrico, cego, randomizado. Lancet Infect Dis. 05.09.2022
- Este subestudo do estudo fase 2 multicêntrico, cego, randomizado e controlado COV-BOOST avaliou a segurança, a imunogenicidade e a reatogenicidade de uma quarta dose de mRNA-1273 (50 μg, n=83) ou BNT162b2 (30 μg, n=83) seguindo os esquemas vacinais ChAdOx1x2:BNT162b2 (n=88) ou BNT162b2x3 (n=78) em pessoas ≥30 anos (idade mediana de 70,1 anos) no Reino Unido
- Foram incluídas 133 pessoas na análise de imunogenicidade por intenção de tratar (mRNA-1273, n=67; BNT162b2, n=66)
- Foram relatados 18 e 16 eventos adversos (AEs) nos grupos mRNA-1273 e BNT162b2, respectivamente; a dor foi a da AE local mais comum, e fadiga, dor de cabeça, mal-estar e dor muscular foram as AEs sistêmicas mais comuns em ambos os grupos; a maioria eram de gravidade leve a moderada
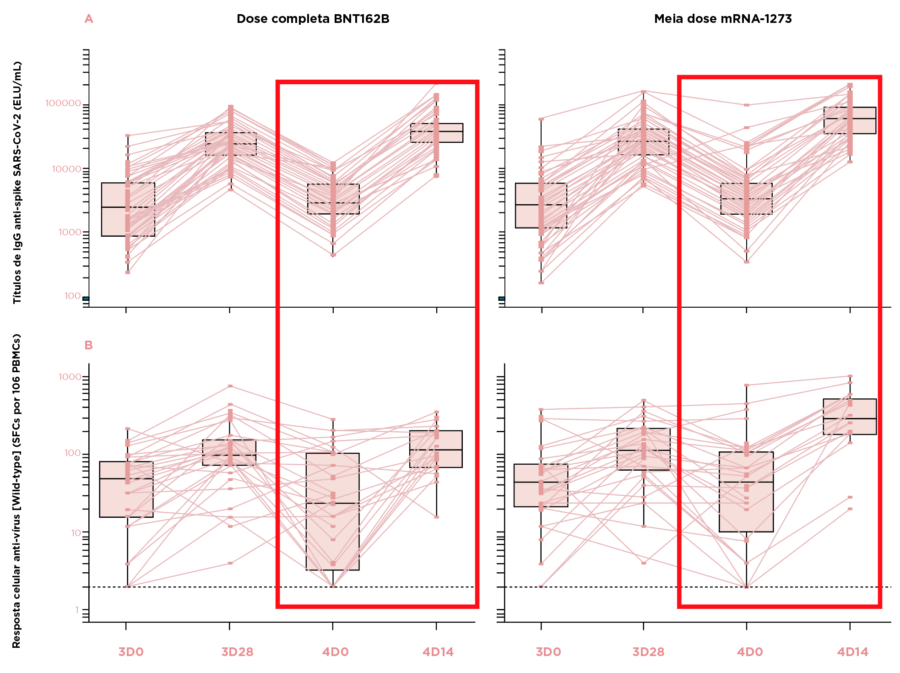
- Os GMTs de IgG anti-spike aumentaram do dia 28 após a dose 3 para o dia 14 após a dose 4, representando uma mudança significativa em ambos os grupos.
- Uma quarta dose de mRNA-1273 apresentou maior variação do aumento da média geométrica em comparação com BNT162b2 (2,19 vs. 1,59, respectivamente).
- O aumento da média geométrica entre o dia 0 (pouco antes da dose 4) e o dia 14 (após a dose 4) variou de 11,14 a 20,26.
Figura: Cinética da imunogenicidade em participantes soronegativos
- No dia 14 após a dose 4, as respostas das células T foram semelhantes às observadas 28 dias após a dose 3 nos grupos ChAdOx1x2:BNT162b2:mRNA-1273, ChAdOx1x2:BNT162b2x2 e BNT162b2x4; As respostas de células T no grupo BNT162b2x3:mRNA-1273 aumentaram significativamente no mesmo período
- Para os participantes previamente infectados com SARS-CoV-2, houve um aumento de 4,63 e 4,89 vezes nos títulos de IgG do dia 0 ao dia 14 após a dose 4 nos grupos mRNA-1273 e BNT162b2, respectivamente
Resumindo: uma quarta vacina COVID-19 mRNA foi segura e forneceu um reforço à imunidade humoral e celular após os regimes de vacina ChAdOx1x2:BNT162b2 e BNT162b2x3; uma quarta dose de mRNA-1273 demonstrou maior imunogenicidade do que os regimes de vacina BNT162b2
SEGURANÇA
Ouldali N, et al. Síndrome hiperinflamatória após a vacina COVID-19 mRNA em crianças: um estudo nacional de farmacovigilância pós-autorização. Lancet Reg Health Eur. 29.04.2022
- Este estudo prospectivo de pós-autorização utilizou um sistema nacional de vigilância farmacovigilância para avaliar a potencial associação entre as vacinas COVID-19 mRNA e a Síndrome Inflamatória Multisisstêmica Pediátrica (SIM-P) em crianças de 12 a 17 anos na França.
- Todos os casos pediátricos de síndrome inflamatória, febre > 3 dias, choque ou falência aguda de órgãos notificados ao sistema de vigilância entre 15 de junho de 2021 e 1 de janeiro de 2022 foram elegíveis.
- O resultado primário foi a taxa de SIM-P após a vacina COVID-19 mRNA por 1.000.000 doses; os desfechos secundários foram suas taxas após as doses 1 e 2, taxas por sexo e comparação de características clínicas após a vacinação ou infecção por SARS-CoV-2
- Foram administradas 8.113.058 doses da vacina mRNA COVID-19 para 4.079.234 crianças (dose 1:4.079.234; dose 2:3.905.636; dose 3, 128.188), e a grande maioria recebeu BNT162b2 (> 95%)
- Entre 2.028 reações adversas a medicamentos, 102 casos de miocardite ou pericardite (não relatados por tipo de vacina [76% masculino, com uma taxa de notificação de 19 por 1.000.000 doses]) e 12 casos de HIS (83% masculino, com taxa de notificação de 2,4 por 1.000.000 doses; mRNA-1273, n=2, BNT162b2, n=10) foram relatados.
- Em crianças infectadas com SARS-CoV-2, houve 130 casos de Síndrome Inflamatória Multisisstêmica Pediátrica (SIM-P), representando uma taxa de SIM-P de 113,3 por 1.000.000 crianças infectadas
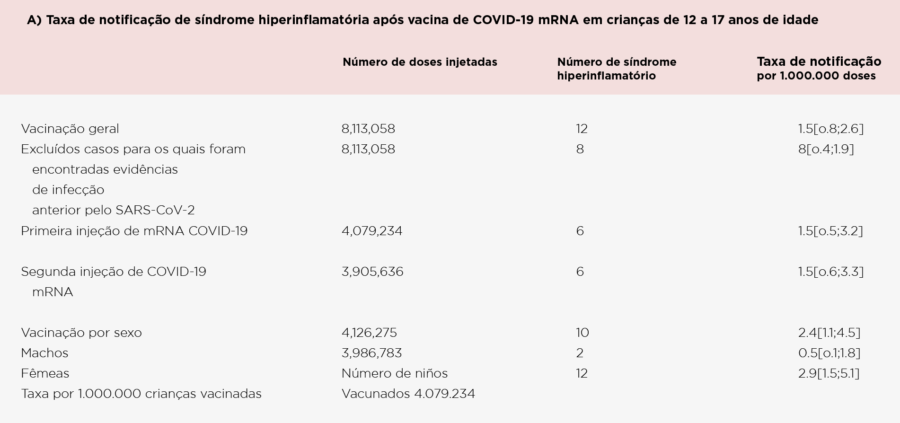

- Os desfechos clínicos de curto prazo apresentaram-se menos graves para síndrome hiper-inflamatória pós-vacina pós em comparação a SIM-P pós-infecção, com menor taxa de transferência para Unidades de Terapia Intensiva Pediátrica (33% vs 72%, respectivamente).
Os desfechos de curto prazo também pareciam menos graves para a síndrome hiper-inflamatória pós-vacina, com menor taxa de transferência picu (4/12, 33%), em comparação com 143/199 (72%) para pós-SARS-CoV-2 MIS-C
Resumindo: A SIM-P após vacina mRNA contra COVID-19 em crianças de 12 a 17 anos é muito rara, frequentemente apresentando gravidade e taxa global menores em relação ao SIM-P pós-SARS-CoV-2; dada a proporção muito baixa de crianças vacinadas com mRNA-1273 neste estudo (<5%), não foi possível estimar com precisão o risco de SIM-P para mRNA-1273
EFETIVIDADE DE MUNDO REAL
Butt AA, et al. Efetividade relativa da vacina de uma dose de reforço da vacina de mRNA SARS-CoV-2 contra a variante Omicron. Clin Infect Dis. 05.03.2022
- Este estudo de coorte retrospectiva, que emula um estudo randomizado hipotético, examinou a eficácia relativa da vacina (rVE) de um reforço vacinal mRNA contra infecção, hospitalização ou doença grave (internação de UTI) entre veteranos dos EUA durante um período de predominância de omicron
- A análise primária comparou a incidência de infecções por SARS-CoV-2 de 1 º de janeiro a 20 de fevereiro de 2022 entre pessoas que receberam uma dose de reforço da mesma vacina (entre 22 de setembro e 25 de dezembro de 2021) e pessoas que ainda não haviam recebido a dose de reforço.
- Foram incluídas 462.950 pessoas que receberam um reforço e 462.950 controles combinados incluídos na análise; 264.090 receberam um reforço mRNA-1273 (idade média de 72 anos, 95,1% masculino, 13,9% negro) e 198.860 receberam um reforço BNT162b2 (idade média de 71 anos, 93,1% masculino, 20,5% preto)
- A rVE foi de 19%, 52% e 83% para infecção, internação e internação ou óbito por UTI,
respectivamente
- rVE para mRNA-1273 foi de 27%, 55% e 72%, respectivamente; rVE para BNT162b2 foi de 11%, 50% e 88%, respectivamente
- A rVE contra infecção foi maior para os pacientes que receberam seu reforço dentro de 28 dias após o início do período dominante de omicron (mRNA: 30%, BNT162b2: 40%); proteção contra infecção foi insignificante em pacientes que receberam seu reforço ≥4 meses antes
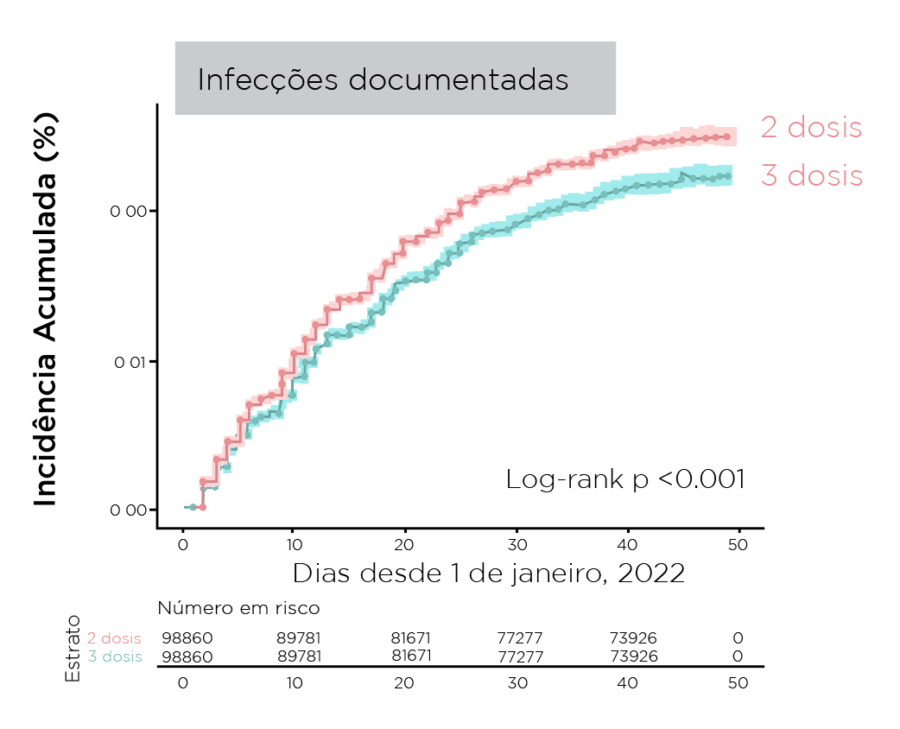
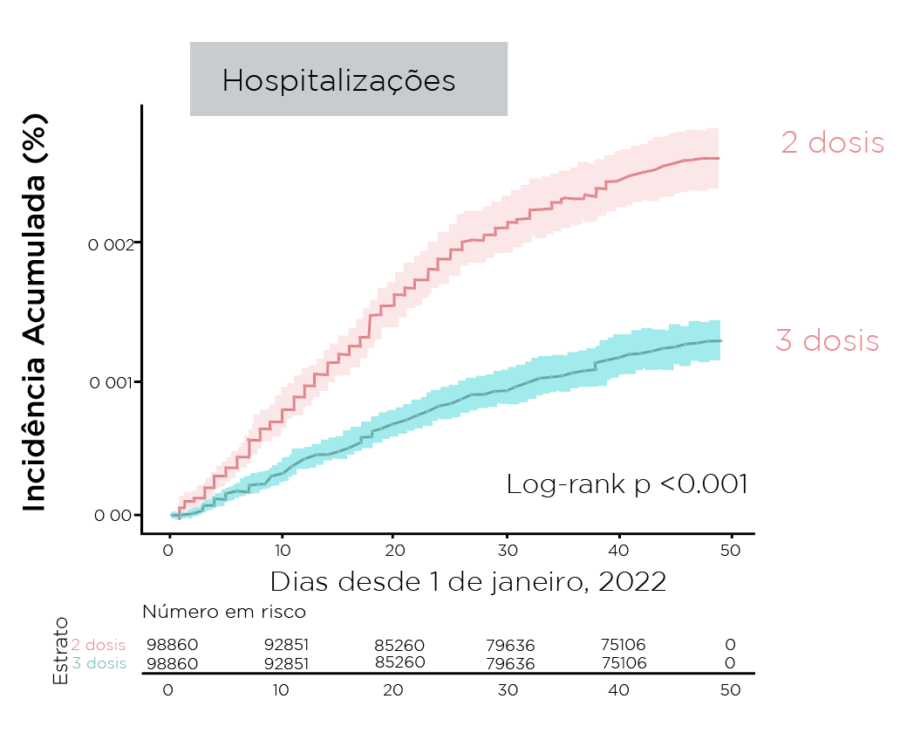
- A incidência cumulativa de infecções e internações foi menor entre os receptores de reforço
Figura. Incidência cumulativa de infecções e internações durante um período dominante omicron
BNT-162b2
mRNA-1273
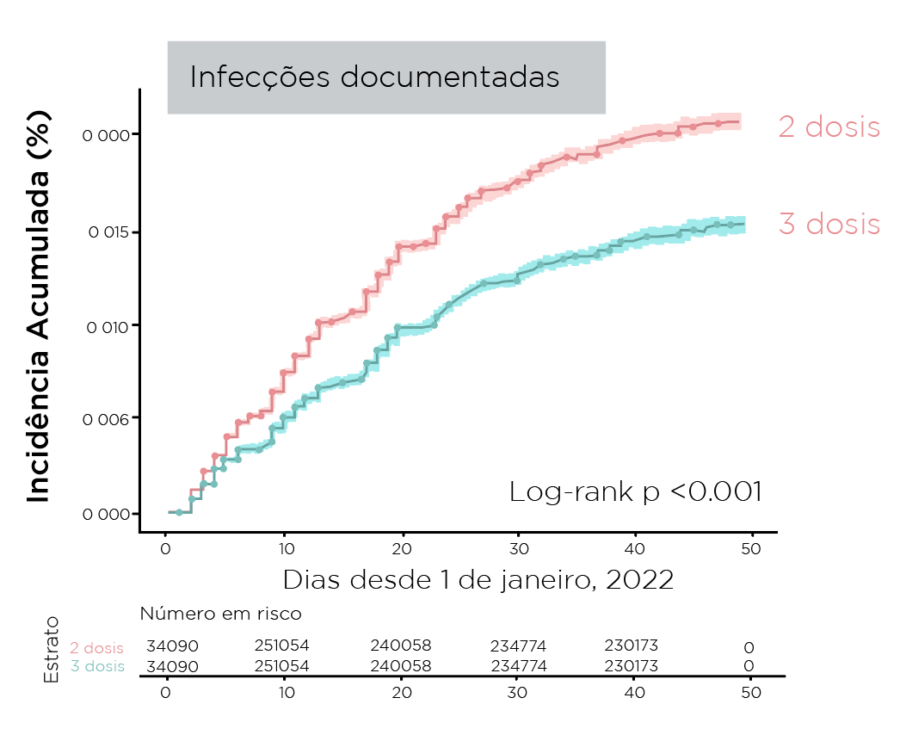
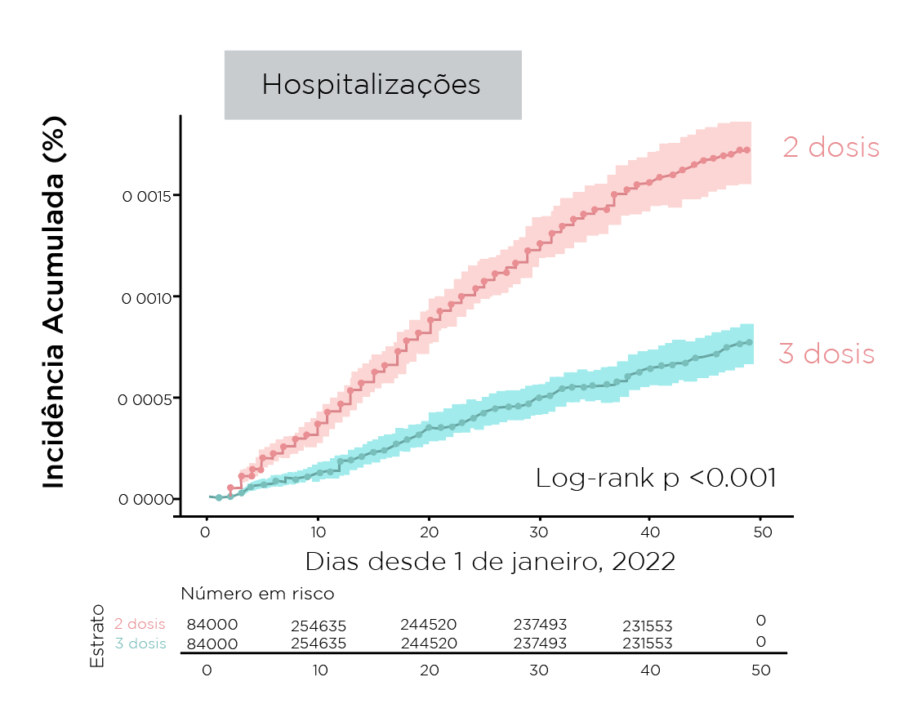
Resumindo: Durante um período dominante em omicron, um reforço vacinal mRNA fornece rVE baixa contra infecção, mas proteção substancial contra internação e doenças graves; mRNA-1273 forneceu rVE numericamente maior contra infecção e hospitalização
EFETIVIDADE DE MUNDO REAL
Belik M, et al. Análise comparativa das respostas da vacina COVID-19 e dos anticorpos neutralizantes contra as variantes Delta e Omicron induzidos pela terceira dose de reforço. Nat Comum. 05.05.2022
- Este estudo avaliou respostas neutralizantes e de anticorpos entre os profissionais de saúde (HCW, n=328) na Finlândia após diferentes combinações de vacinas mRNA-1273, BNT162b2 ou ChAdOx1
- Intervalo largo de 12 semanas (mRNA-1273[x2], n=72; BNT162b2[x2], n=62; ChAdOx1:mRNA-1273, n=22; ChAdOx1:BNT162b2, n=52)
- Intervalo curto de 3 semanas (BNT162b2[x2]:mRNA1273, n=47; BNT162b2[x3], n=120)
- As coortes foram representativas demograficamente (87% do sexo feminino, média de 44 anos; 13% do sexo masculino, média de 46 anos)
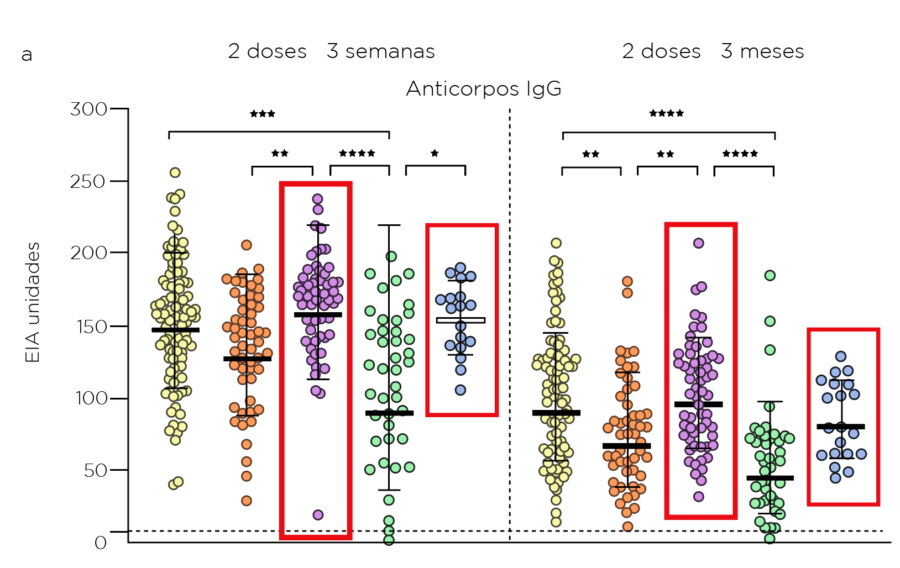
- Nos grupos com longo intervalo, os GMTs de IgG foram mais elevados nos grupos vacinais que incluíram mRNA-1273 como a segunda dose, 3 semanas e 3 meses após a dose 2 (153-158 e 80-96, respectivamente), enquanto os grupos BNT162b2 tiveram os menores GMTS (89-147 e 44-90, respectivamente).
- O grupo mRNA-1273×2 obteve maior GMT ID50 neutralizante contra D614G e Delta em comparação com outras combinações de vacinas
- Os níveis de anticorpos diminuíram ao longo do tempo, mas foram detectados em 99% (170/172) dos HWCs 3 meses após a dose 2
- Nos grupos com intervalo curto de dose, 87% (95/105) dos profissionais de saúde que receberam 2x BNT162b2 apresentaram níveis detectáveis de anticorpos IgG 7-9 meses após a dose 2
Três semanas após uma dose de reforço de mRNA-1273 ou BNT162b2, os níveis de anticorpos foram significativamente superiores a 3 semanas após a dose 2 (180 vs. 147, respectivamente); os resultados não foram significativamente diferentes entre os reforços
Figura. Anticorpos neutralizantes SARS-CoV-2 após duas doses de diferentes combinações de vacinas COVID-19


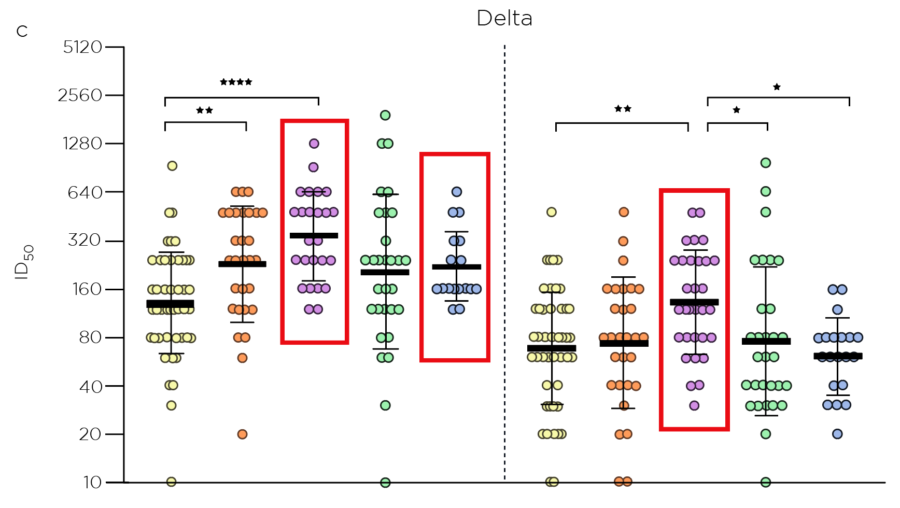
- Os níveis de neutralização de um grupo de 59 profissionais de saúde selecionados aleatoriamente que receberam BNT162b2x3 foram de 100%, 98% e 24% contra D614G, delta e omicron, respectivamente, 3 semanas após a dose 2; 3 semanas após a dose 3 (reforço), 100% dos soros dos vacinados foram neutralizantes contra as 3 variantes; a neutralização contra omicron não foi avaliada para mRNA-1273
Resumindo: As respostas de anticorpos e os níveis de neutralização são mais elevados após os esquemas com vacinas homólogas (mRNA-1273×2) ou heterólogas (BNT162b2x2:mRNA-1273 ou ChAdOx1:mRNA-1 273), em comparação aos esquemas com vacinas homólogas (BNT162b2x3) ou heterologas (ChAdOx1:BNT162b2), esquemas vacinais BNT162b2 D614G, e variantes delta

Sorry, the comment form is closed at this time.