
Princípios de escolha dos fármacos e tomada de decisão compartilhada
O tratamento das epilepsias com fármacos antiepilépticos (FAEs) tem como objetivo o controle total de crises e a melhora da qualidade de vida, com menor índice de eventos adversos possíveis. Entretanto, nem sempre é possível atingir o controle completo das crises. Entre 60% e 70% dos pacientes com epilepsias respondem bem às primeiras tentativas de FAEs1-5 e podem ficar livres de crises ou entrar em remissão,
mesmo quando apresentam lesões na ressonância magnética.6
É recomendado que o tratamento inicial das epilepsias seja com um FAE em monoterapia. A escolha do FAE deve levar em conta, além da sua eficácia, o perfil de efeitos adversos e tolerabilidade, riscos de tera-togenicidade, outros medicamentos em uso, bem como o custo.7-9
Vários FAEs apresentam eficácia semelhante, porém o perfil de efeitos adversos e a interação com outros medicamentos são bastante variados.2 Portanto, a escolha do FAE depende das características individu-ais, do tipo de crise e do perfil fármaco-econômico de cada paciente. A decisão de qual FAE deve ser usado para o início do tratamento, bem como a troca ou adição de FAE, deve ser compartilhada com o paciente e sua família.
É necessário informar ao paciente as vantagens e desvantagens de cada FAE, incluindo custo e efeitos adversos. Também é fundamental explicar quais são os efeitos adversos que podem ser minimizados com a titulação lenta, quais serão provavelmente transitórios e quais são potencialmente graves. Assim, a pro- babilidade de o paciente abandonar o tratamento nas primeiras semanas será menor e aumentará a chan-ce de boa adesão ao tratamento.
Sabe-se que, quando não há controle de crises após a tentativa do terceiro FAE, a probabilidade de controle total de crises é baixa.7,8 Por isso, quando há falha no controle de crises após a tentativa de FAEs (em mono ou politerapia) utilizando pelo menos dois esquemas adequados, bem tolerados e com boa adesão, o paciente é considerado farmacorresistente.3 Portanto, novas opções medicamentosas são fundamen-tais para cerca de 30% dos pacientes que não respondem às primeiras tentativas com FAEs3-5. Para esses pacientes, o objetivo passa então a ser a redução da frequência e da gravidade das crises, sem toxicidade 3,4.
A maioria dos FAEs tem um índice terapêutico estreito e muitos afetam a atividade de enzimas metaboliza-doras de drogas e podem provocar interações medicamentosas clinicamente relevantes com efeitos adver-sos4,7. Vários FAEs, sobretudo os mais antigos, têm um alto potencial para interações medicamentosas clinicamente importantes. A maioria dessas interações envolve indução ou inibição de enzimas metaboli-zadoras de fármacos e pode ser prenunciada por meio do conhecimento dos mecanismos básicos de cada um desses FAEs4. Em geral, as interações entre FAEs podem ser minimizadas pelo ajuste da dose e moni-toração cuidadosa da resposta clínica.
Algumas interações com outros tipos de fármacos podem ter sérias consequências e nem sempre podem ser resolvidas com ajustes de dosagem.4
As interações entre FAEs ou entre FAEs e outras drogas podem ser de natureza farmacocinética ou farma-codinâmica.
As interações farmacocinéticas envolvem mudanças no metabolismo do fármaco ou, menos frequente-mente, absorção de fármacos, distribuição e excreção renal e estão associadas a uma alteração na con- centração sérica do fármaco afetado3,4,7,8. As interações farmacodinâmicas ocorrem no local de ação e não envolvem mudanças na concentração sérica do fármaco afetado4,7.
A maioria das interações clinicamente importantes de FAEs resulta da indução ou inibição do metabolismo do fármaco. A carbamazepina, a fenitoína, o fenobarbital e a primidona são indutores fortes do citocromo P450 e enzimas glucuronizantes e reduzem a eficácia de medicamentos coadministrados, como anticoa-gulantes orais, antagonistas de cálcio, esteroides, antimicrobianos e antineoplásicos 3,4.
O valproato é um inibidor do citocromo P450 e apresenta efeito contrário, aumentando o nível sérico de medicamentos com metabolização hepática. Exemplos de interações importantes mediadas pela inibição enzimática incluem o aumento da concentração sérica de fenobarbital e lamotrigina causado pelo valproato 3,4.
A oxcarbazepina, a rufinamida e o topiramato (em doses maiores que 200 mg/dia) apresentam proprieda-des indutoras mais fracas e menor propensão a causar interações mediadas pela indução enzimática 4,8.
Existem ainda interações em que outros fármacos induzem ou inibem o metabolismo de FAEs, como o aumento da concentração sérica de carbamazepina pela eritromicina e a diminuição da concentração séri- ca de lamotrigina por contraceptivos contendo estrogênio 4,8.
Até um quarto das pessoas com epilepsia usa dois ou mais FAEs, e essa proporção aumenta para mais de 75% entre os pacientes farmacorresistentes atendidos em centros terciários.7 Existe alta probabilidade de os FAEs serem prescritos com outras medicações em algum momento da vida, principalmente em idosos; portanto, mesmo em monoterapia, é interessante escolher um FAE que não interfira na metabolização hepática 3,4.
Nem todos os efeitos adversos são causados por interações medicamentosas. Existem os efeitos adver- sos associados aos mecanismos de ação dos FAEs e efeitos adversos inerentes a um FAE em particular, que não necessariamente tem relação direta com o seu principal mecanismo de ação para o controle de crises epilépticas 3,4.
Em primeiro lugar, é importante evitar associações entre fármacos com mecanismos de ações similares, pois isso aumenta os efeitos adversos sem um grande aumento na sua eficácia. (Tabela 1) Em segundo lugar, deve-se tentar evitar certos FAEs conforme as comorbidades prévias dos pacientes e os principais efeitos adversos de cada FAE, que são descritos adiante. Por exemplo, evitar oxcarbazepina e carbamaze-pina em idosos em uso de diuréticos devido ao risco aumentado de hiponatremia; evitar valproato em pes-soas com obesidade e diabetes, e em mulheres em idade fértil; evitar levetiracetam em pessoas com his- tórico de depressão; evitar topiramato em pacientes com litíase renal e glaucoma etc.
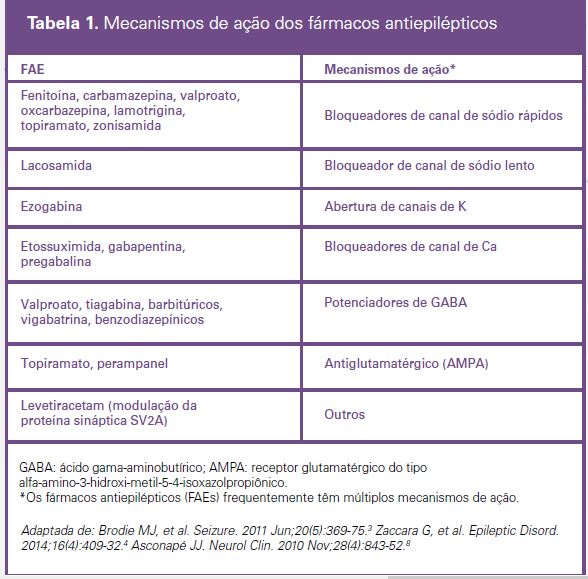
Alguns dos FAEs de geração mais recente não interferem na metabolização hepática e são menos propen- sos a causar interações clinicamente relevantes quando utilizados com outros FAEs ou outros medicamen-tos utilizados com frequência em pessoas com epilepsia, incluindo levetiracetam, lacosamida, gabapentina e pregabalina 3,4,7,8.
Em conclusão, o paciente deve participar na escolha do tratamento com FAEs. É preciso esclarecer que existem alternativas e que muitas vezes, mesmo com o bom controle de crises, a eventual troca de FAE pode melhorar a qualidade de vida do paciente que apresenta efeitos adversos significativos, incluindo sonolência excessiva, dificuldade de concentração, que atrapalha as atividades laborativas, ganho de peso, entre outros.
Referências
1. Brodie MJ, Barry SJ, Bamagous GA, Norrie JD, Kwan P. Patterns of treatment response in newly diagno-sed epilepsy. Neurology. 2012 May 15;78(20):1548-54.
2. Glauser T, Ben-Menachem E, Bourgeois B, Cnaan A, Guerreiro C, Kälviäinen R, et al. Updated ILAE eviden-ce review of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Epilepsia. 2013 Mar;54(3):551-63.
3. Brodie MJ, Sills GJ. Combining antiepileptic drugs – rational polytherapy? Seizure. 2011 Jun;20(5):369-
75.
4. Zaccara G, Perucca E. Interactions between antiepileptic drugs, and between antiepileptic drugs and other drugs. Epileptic Disord. 2014;16(4):409-32.
5. Kwan P, Arzimanoglou A, Berg AT, Brodie MJ, Allen Hauser W, Mathern G, et al. Definition of drug resistant epilepsy: consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Epilepsia. 2010 Jun;51(6):1069-77.
6. Cendes F. Neuroimaging predictors of AED resistance in new-onset epilepsies. Epilepsia. 2011 Jul;52 Suppl 4:7-9.
7. Brodie MJ, Mintzer S, Pack AM, Gidal BE, Vecht CJ, Schmidt D. Enzyme induction with antiepileptic drugs: cause for concern? Epilepsia. 2013 Jan;54(1):11-27.
8. Asconapé JJ. The selection of antiepileptic drugs for the treatment of epilepsy in children and adults. Neurol Clin. 2010 Nov;28(4):843-52. 9. Tomson T, Battino D, Bonizzoni E, Craig J, Lindhout D, Sabers A, et al.; EURAP study group. Dose-dependent risk of malformations with antiepileptic drugs: an analysis of data from the EURAP epilepsy and pregnancy registry. Lancet Neurol. 2011 Jul;10(7):609-17.
Prof. Dr. Fernando Cendes CRM-SP 54.896
Professor titular e chefe do Departamento de Neurologia da Faculdade de Ciências Médicas (FCM) da Universidade Estadual de Campinas (Unicamp). Coordenador do Serviço de Epilepsia da FCM-Unicamp, Campinas, SP.

Sorry, the comment form is closed at this time.